相当多的蛋白质行使功能的时候并不是单打独斗的,蛋白质们通过蛋白质相互作用形成复合体然后进行工作。因此,研究蛋白质的相互作用成为研究蛋白质功能和作用机制的最为重要的环节之一。
研究蛋白互作的方法有很多,今天就几种常用的方法做个简单的概述,希望能够帮助到大家。
1、酵母双杂交系统
原理:很多真核生物的位点特异转录激活因子通常具有两个可分割开的结构域,即DNA特异结合域(DNA-binding domain, BD)与转录激活域(Transcriptional activationdomain, AD)。这两个结构域各具功能,互不影响,但一个完整的激活特定基因表达的激活因子必须同时含有这两个结构域,否则无法完成激活功能。
将两待测研究蛋白(蛋白X与蛋白Y)分别与BD、AD结构域构建融合质粒。将构建好的两个质粒转入同一酵母细胞中表达,如果两蛋白之间不存在相互作用,则下游基因(报告基因)不会转录表达;如果两个蛋白存在相互作用,则BD与AD两结构域空间上很接近,从而下游基因(报告基因)得到转录。判断通过报告基因表达与否,即可判断两蛋白之间是否存在相互作用。
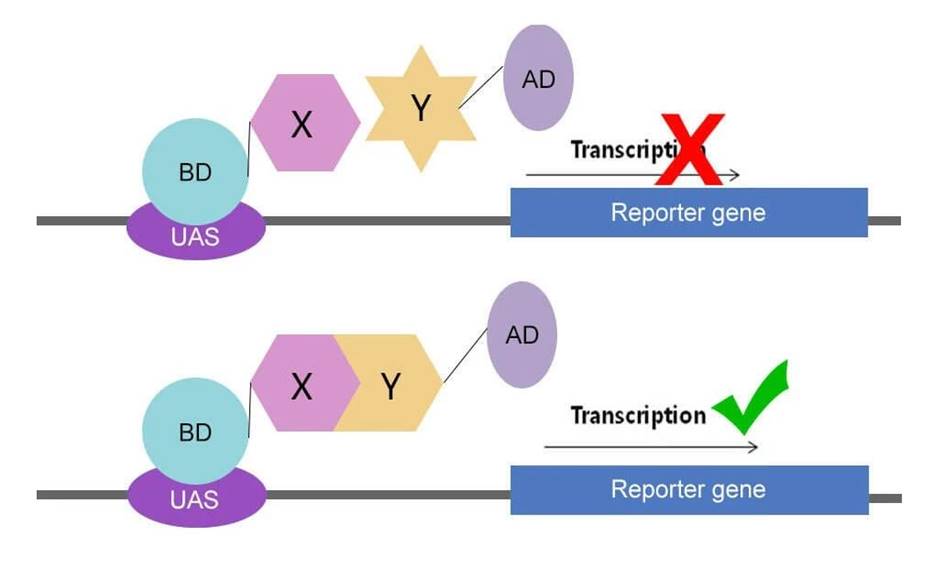
用酵母双杂交系统能够快速、直接分析已知蛋白之间的相互作用,并能寻找、分离与已知蛋白相互作用的配体,在研究抗原和抗体相互作用、发现新的蛋白质和发现蛋白质的新功能、筛选药物作用位点及药物对蛋白互作影响、建立基因组蛋白连锁图等方面应用广泛。
2、免疫共沉淀
免疫共沉淀(Co-Immunoprecipitation,Co-IP)是一种以抗体和抗原之间的专一性作用为基础的用于研究两个蛋白相互作用的经典方法。
原理:基于抗体与抗原(靶蛋白)之间的特异性结合,此时如果样品溶液中存在能与靶蛋白相互作用的目的蛋白,会一同被拉下来,随后利用SDS-PAGE,Western Blot等方法对得到的目标蛋白进行分析,进而证明两者间的相互作用。
通俗点来说,假设我们需要研究样品中A蛋白和B蛋白之间是否存在一些相互作用,首先我们通过合适的方法处理样本,将蛋白提取出来(同时不能破坏蛋白之间的相互作用),然后用预先结合了琼脂糖珠或者磁珠的A蛋白抗体捕获样本中的A蛋白,那么与A蛋白结合的B蛋白也能一起沉淀下来。再将蛋白从珠子上裂解下来,对B蛋白进行检测,能检测到,说明B蛋白在之前的沉淀过程中随着A蛋白一起被拉下来了,进而证明二者之间存在相互关系。
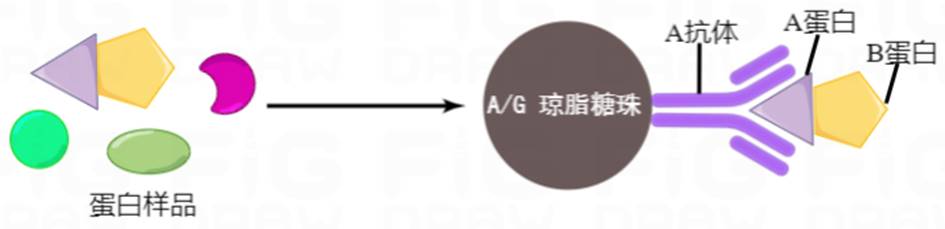
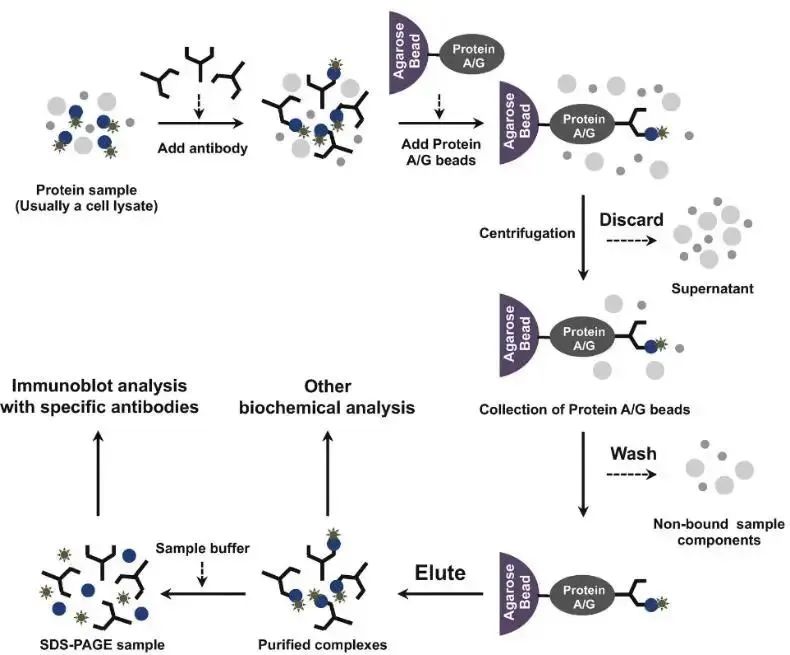
(DOI: 10.1007/978-1-4939-7033-9_17)
3、免疫荧光共定位
将免疫学方法(抗原抗体特异结合)与荧光标记技术结合起来研究特异蛋白抗原在细胞内分布的方法。一般用来验证2种或3种蛋白是否存在共定位关系。
由于荧光素所发的荧光可在荧光显微镜下检出,从而可对抗原进行细胞定位。两种不同的蛋白使用不同属性的不同颜色荧光标记后,通过观察颜色的变化确定是否有共定位,也可以使用软件进行分析。
该技术的主要特点是:特异性强、敏感性高、速度快。主要缺点是:非特异性染色问题尚未完全解决,结果判定的客观性不足,技术程序也还比较复杂。
4、Pull-down实验
Pull-down实验,又称拉下实验,是一种体外亲和纯化技术。(这个实验跟免疫共沉淀实验很像,不同的是免疫共沉淀是在细胞里进行的。)
原理:将一种蛋白质固定于某种基质上(如Sepharose),但细胞抽提液经过该基质时,可与该固定蛋白相互作用的配体蛋白被吸附,而没有被吸附的“杂质”则随洗脱液流出。被吸附的蛋白可以通过改变洗脱液或洗脱条件而回收下来。
为了更有效地利用pull down技术,可以将待纯化的蛋白以融合蛋白的形式表达,即将“诱饵”蛋白与一种易于纯化的配体蛋白相融合。1988年Smith等利用谷胱甘肽-S-转移酶(GST)融合标签从细菌中一步纯化出GST融合蛋白。
GST Pull-Down实验:利用DNA重组技术将已知蛋白与GST融合,而融合蛋白通过GST与固化在载体上的GTH(谷胱甘肽)亲和结合。简单来说,我们假定a蛋白和b蛋白可能存在互作,将纯化的融合GST的a蛋白和纯化的b蛋白以及能特异性结合GST的Sephrose 4B beads混合在一起孵育一定时间,然后洗去未结合的蛋白,煮沸beads进行SDS-PAGE电泳。通过Western blot检测结果,我们可以看到GST-a蛋白和b蛋白所对应的条带,即表明了a蛋白和b蛋白因发生相互作用而被GST-a pull down(GST对照只显示一个条带)。
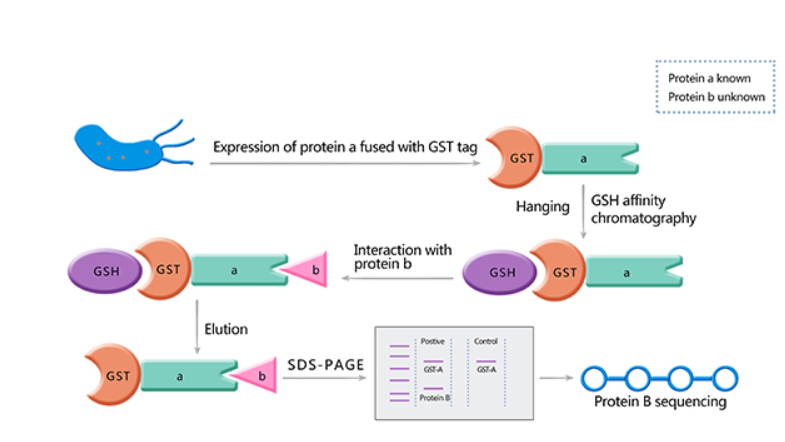
pull down技术可用于验证已知蛋白或肽的相互作用,也可以用来筛选与已知蛋白或肽互作的未知蛋白或肽。但是在一定程度上不能真实反应细胞内蛋白质之间的相互作用,因为在体外相互作用的蛋白质在正常生理条件下不一定会相互结合。
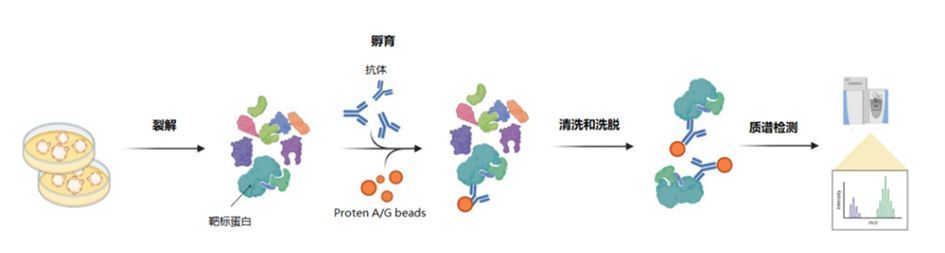
5、亲和纯化质谱(AP -MS)
AP-MS(Affinity Purification coupled MS),即亲和纯化串联质谱分析。
原理:基于特异性抗体或其他亲和试剂与靶标蛋白的亲和作用,通过免疫共沉淀(co-Immunoprecipitation)将靶标蛋白与靶标蛋白的相互作用蛋白从复杂的生物体系中纯化出来,进而进行质谱检测以鉴定靶标蛋白的相互作用蛋白。
经典的AP-MS实验通常包含以下4个关键步骤:1)细胞或组织的裂解;2)蛋白溶液与偶联抗体的亲和微珠的孵育;3)非特异性结合和背景蛋白的清洗以及特异性互作蛋白的洗脱;4)互作蛋白的质谱检测和分析。
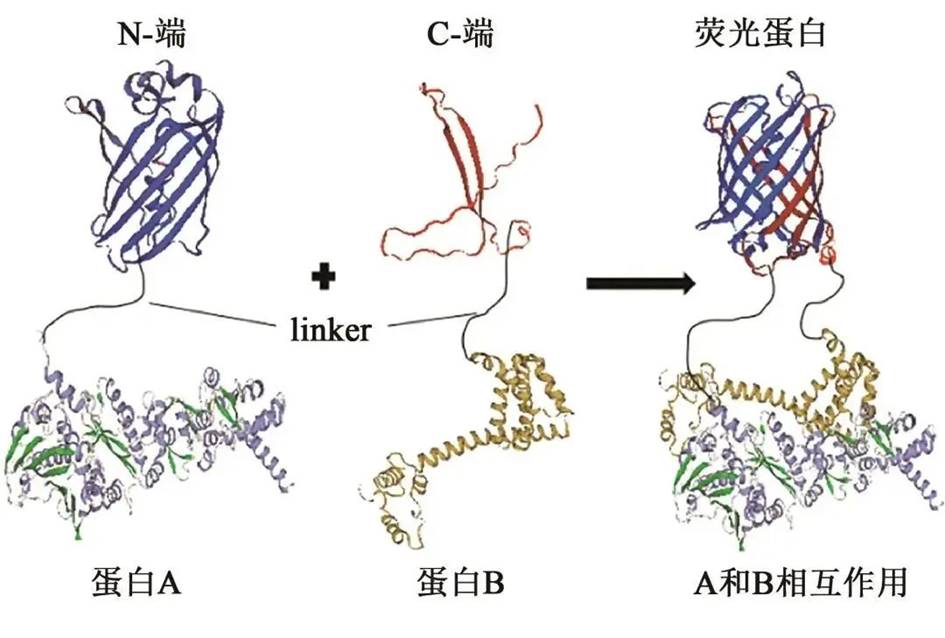
6、双分子荧光互补技术
双分子荧光互补(Bimolecular fluorescence complementation, BiFC),该技术是利用荧光蛋白的特点来研究蛋白的相互作用。
荧光蛋白可从特定的位点被分开,产生两个非荧光活性片段即N端片段(N-fragment)和C端片段(C-fragment)(VN及VC)。当两片段分别被融合到相互作用的蛋白上时,会因蛋白的相互作用力而被拉近、发生互补从而重新构建成有活性的荧光蛋白并在激发光下产生荧光。因此利用荧光显微镜就可以直接通过观察荧光有无来判断蛋白是否发生相互作用。
这是在活细胞中观察蛋白相互作用的很好的方法。
这个方法还是存在假阳性的,细胞里大量表达的分段的黄色荧光蛋白(YFP)可能会不受研究蛋白的结合与否而自己结合在一起,所以阴性对照的使用非常重要。
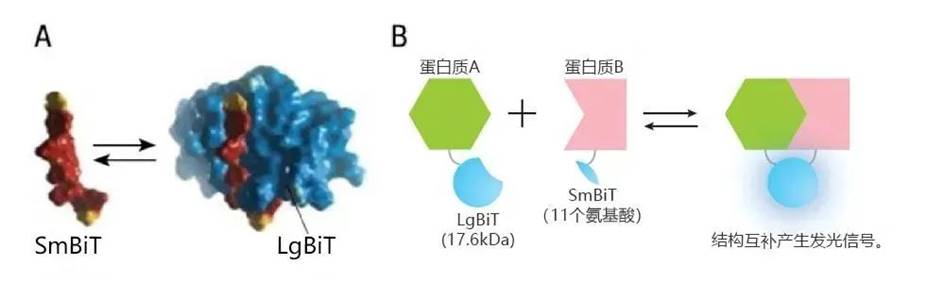
7、NanoBiT 蛋白互补技术
此方法与BIFC的最大区别在于,BIFC拆分的是YFP荧光蛋白,NanoBiT拆分的是萤火虫荧光素酶 Luciferase。荧光素酶需要有底物的存在,发出的是自发荧光而非激发光 。这类技术的好处是可以在活细胞里进行观测,可以进行实时监控,定量等实验。
该方法利用分子生物学方法将NanoBit蛋白拆分成17.6kDa的LgBit和11个氨基酸的SmBit,分别作为蛋白表达载体上面的两个标签,当两个蛋白可以发生互作时,LgBit和SmBit空间距离拉近,结构互补形成完整的NanoBit蛋白,在底物检测下可以发出很强的luminescent 信号。
由于NanoBit蛋白分子量小,光信号强,表达效率高,非特异性自发光背景低,并且标签蛋白结合是可逆的,所以这个方法较BIFC有很多优势。
此实验早期需要摸索LgBit和SmBit构建在不同的N端或C端的组合。
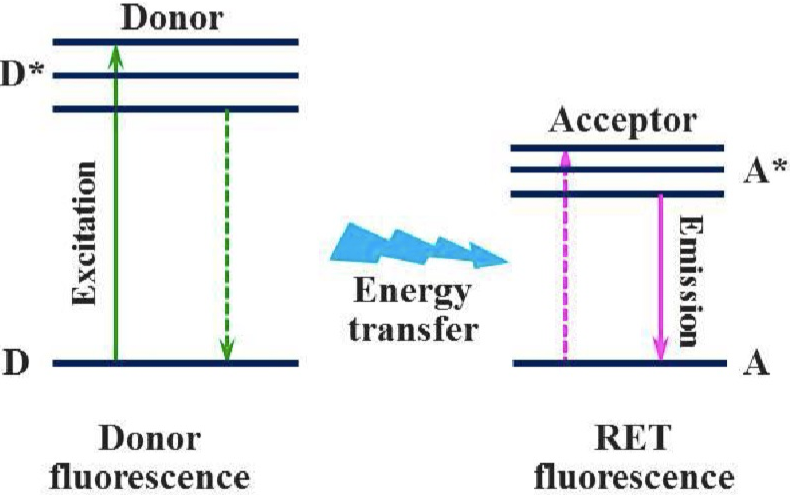
8、荧光共振能量转移
荧光共振能量转移(Fluorescent Resonance Energy Transfer, FRET)是一种通过荧光物质间发生非辐射能量转移进行分析的光谱分析法。
当供体荧光分子的发射光谱与受体荧光分子的吸收光谱重叠,并且两个分子的距离在10nm范围以内时,就会发生一种非放射性的能量转移,即FRET现象,使得供体的荧光强度比它单独存在时要低的多(荧光猝灭),而受体发射的荧光却大大增强(敏化荧光)。
青色荧光蛋白(cyan fluorescent protein, CFP)、黄色荧光蛋白(yellow fluorescent protein, YFP)为目前蛋白-蛋白相互作用研究中最广泛应用的FRET对。
这项技术不仅能验证蛋白质的相互作用,还能够表征这种相互作用距离的动态变化,比如蛋白质分子直接相对运动的方向速度等。
9、生物发光能量共振转移(BRET)
用生物发光蛋白替代荧光供体,不依赖于激发光,检测背景低。
在BRET技术中,蛋白A融合荧光素酶(通常是海肾荧光素酶),作为能量供体,蛋白B融合带有荧光基团的标签蛋白,作为能量受体,如果蛋白A、B存在相互作用时,加入荧光素酶底物后,荧光素酶发光可以激发临近的蛋白B的荧光基团发光,通过检测荧光和发光信号比值,来检测蛋白相互作用。如果蛋白A和B无相互作用,荧光素酶发光的能量将无法传递到受体蛋白,从而受体蛋白不会被激发产生荧光信号。
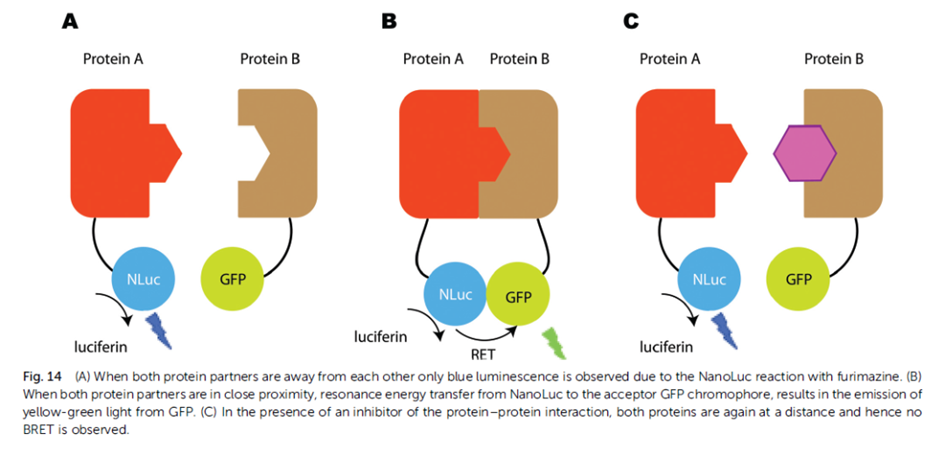
这个方法与FRET相比,用生物发光蛋白替代荧光供体,不依赖于激发光,检测背景低;不需要漂白,细胞损坏更少;同时也避免了自发荧光干扰;作为供体的NanoLuc萤光素酶蛋白分子量小,更适合融合蛋白表达构建,并且光信号强。
但是,它需要配对的底物,并且这个底物还不便宜,需要大量使用的话要考虑好经济问题。
10、DUOLINK实验
Duolink实验基于邻位连接技术(proximity ligation assay,PLA),当一对PLA probes足够接近时(小于40 nm)会产生PLA信号,由于PLA probes特异识别一抗, PLA信号的强弱直接反映了蛋白表达量水平或蛋白互作的强度。
利用荧光显微镜可以观察到PLA信号及其位置,通过Duolink ImageTool 可以进行精确的定量和表达差异等分析。Duolink实验能同时实现对蛋白-蛋白互作、蛋白表达或蛋白翻译后修饰进行定位、定量和检测。
通过Duolink技术,可将蛋白信号放大1000倍,肉眼即可检测蛋白及其互作,且整个实验方案简单直接。














